•••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••
- L’Or, l’Argent, le Fer, le Cuivre, le Mercure, le Plomb et l’Étain, sont connus de toute antiquité.
- Le Bismuth est cité dans un traité d’alchimie d’Agricola de 1520.
- Le Zinc était connu de Paracelse vers 1540.
- L’Antimoine fait l’objet d’écrits de Basile Valentin au XVème siècle.
- L’Arsenic et le Cobalt sont découverts par Brand vers 1723.
- Le Platine est détecté par Wood en 1741.
Dates de découverte des métaux
Suit la découverte de plusieurs métaux sans utilisation alchimique, puis Vauquelin découvre le Chrome en 1797, Davy le Potassium et le Sodium en 1807, Hermann, Stromayer le Cadmium en 1818, Wolher l’Aluminium en 1827, et Bussy isole le Magnésium en 1828.On constate que tous les métaux utilisés pour l’alchimie étaient connus depuis l’aube de l’humanité et que, pour ceux dont la découverte est plus tardive, ils étaient utilisés à l’état de sels, qui eux étaient connus sans que leur appartenance au règne métallique soit soupçonnée.
ANTIMOINE
Fiche technique
Formule Sb, masse molaire 121,75 g/mol, densité 6,69, température de fusion 630,7 °C, température d’ébullition variable selon les auteurs de 1380 à 1950 °C, semble difficile à déterminer.
Histoire
Du latin stibium, l’antimoine métal a longtemps porté le nom de régule d’antimoine. Le nom d’antimoine était au Moyen-âge réservé à son minerai sulfuré, la stibine exploitée dans de nombreux gisements.

Ceci est cause de bien des confusions lors de la lecture d’ouvrages anciens, car il est presque impossible de savoir avec certitude la terminologie employée, en particulier pour les textes réédités à cette époque.
Il semble que Basile Valentin soit le premier à avoir obtenu le métal, son « lion oriental ». Les alchimistes suivants lui trouvèrent un grand nombre d’autres noms, en particulier « plomb des Sages » et « plomb des Philosophes ».
Son minerai pratiquement unique, si on exclut quelques très rares échantillons natifs, est la stibine, voir notre article de 2006. La stibine est accompagnée de gangues diverses d’où on la retire par liquation, c’était alors, que pour les Anciens elle prenait pour nom « antimoine crud ». La stibine est un trisulfure d’antimoine de formule Sb2S3 qui a pour masse moléculaire 339,7 g/mol, une densité de 4,12, un point de fusion de 550 °C, et un point d’ébullition de 1150 °C.
La stibine provoque des irritations de la peau, des yeux, des muqueuses.
La stibine, en poudre très fine a, malgré ces inconvénients, été très longtemps (est encore) utilisée par les femmes de certains pays comme fard pour le visage. La photo suivante [image 0] montre un flacon utilisé pour contenir ce « Kool ».
Si elle est chauffée, elle émet des fumées toxiques. Il y a des risques d’incendie si elle est mise en contact avec de l’oxyde d’argent.
La source d’antimoine métal, pour les alchimistes, provient du traitement de l’antimoine crud par l’opération de séparation,. Voir notre article du même nom de 2007.
La coulé de l’antimoine que l’on continue d’appeler régule, (premier régule) ne présente jamais à ce stade la figure d’étoile, [images 1 à 3] mais des coulées de purification améliorent peu à peu le métal que l’on voit progressivement [images 4 à 7] devenir un monocristal clivable et que l’on peut concasser pour le rendre semblable à celui livré par l’industrie [image 8].








Propriétés
L’antimoine, du fait de son bas point de fusion, fut un des métaux les plus étudiés par les alchimistes qui ont par la suite légué aux chimistes un très grand nombre d’observations. Sa richesse dans la croûte terrestre est faible, mais il se trouve que la stibine est rassemblée en gisements, ce qui compense sa rareté lors de l’exploitation. On la trouve dans le calcaire ou le schiste et associée à d’autres minerais comme la galène, l’or, le cinabre, ce qui a favorisé son exploitation dans le monde entier.
Présente dans de nombreux pays, Roumanie, États-Unis, Pérou et Mexique, on la trouve aussi au Japon, mais le principal gisement se trouve dans la province d’Unan en Chine. La France fut, pendant tout le Moyen-âge, un très gros producteur, cependant le coût du minerai étranger fut la cause de la fermeture de la dernière riche mine de Bretagne, après seulement un an d’exploitation.
Nous ne pouvons pas citer ici tous les produits étudiés pendant des siècles par les alchimistes, nous nous contenterons donc de quelques-uns qui sont toujours d’actualité pour eux.
En chauffant à 1000 °C de l’antimoine métal dans un courant d’air, on génère du trioxyde d’antimoine de formule Sb2O3 de masse molaire 291,5 g/mol. Ce trioxyde de di antimoine, oxyde d’antimoine III ou blanc d’antimoine, fond à 656 °C et a une densité de 5,5. C’est une poudre blanche cristalline non combustible mais décomposable à haute température.
Le trichlorure d’antimoine, de formule SbCl3 connu des alchimistes sous le nom de beurre d’antimoine du fait de son aspect, a une masse moléculaire de 228,1 g/mol, un point de fusion de 73 °C et un point d’ébullition de 223 °C. Ce beurre, de densité 3,14, est soluble dans l’eau à raison de 100 g/litre. Il est corrosif pour les yeux, la peau et les voies respiratoires.
Sans entrer dans les détails, nous pouvons citer : le soufre doré d’antimoine, le safran de Mars antimonié apéritif de M. Stahl, le lilium minéral, le lilium de Paracelse, le foie d’antimoine, le kermès minéral, le précipité d’antimoine par l’eau régale, l’antimoine diaphorétique, les fleurs rouges d’antimoine, la neige d’antimoine, la poudre d’Algarotti, le bézoard minéral, la panacée antimoniale, l’huile d’antimoine caustique, la teinture d’antimoine, la teinture de verre d’antimoine, et toutes les variantes de ces préparations.
Toxicologie
Il faut distinguer les risques liés au travail sur l’antimoine depuis le minerai jusqu’au métal. Ils demandent uniquement une protection physique, des yeux et des mains en particulier, car on se fait souvent de petites blessures au concassage par lesquelles l’arsenic, toujours présent dans le minerai, passe dans le sang. Lors du travail au fourneau il y a dégagement de fumées, arsenic, soufre, oxydes d’antimoine, etc. qu’il est indispensable de ne pas respirer.
Lors des travaux sur le métal, de nouveaux risques viennent s’ajouter, chimiques cette fois, selon que l’on utilise de la soude, des acides ou du mercure, etc… il est naturel de réfléchir avant d’agir, et de se protéger. Si la peau peut repousser, ce n’est pas le cas des yeux. Quand à l’absorption du régule purifié, les Anciens ont longtemps utilisé la pilule perpétuelle, et bu leur vin dans des gobelets en régule, sans savoir que l’antimoine est un métal lourd. Vous, vous le savez, et il existe des laxatifs vous dispensant d’utiliser votre régule de façon pharmaceutique.
ARGENT
Fiche technique
Formule Ag, masse molaire 107,87 g/mol, densité 10,53, température de fusion 960,5 °C, température d’ébullition 2000 °C. C’est, par ordre d’importance, le 68 ème élément de l’écorce terrestre.
Histoire
L’argent natif, [images 1 à 4] était déjà utilisé en Egypte, 3500 ans avant notre ère, ainsi que dans la région de l’Euphrate.
Son nom vient du latin « argentum » dérivé du grec « argyros » (l’œuvre au blanc est l’argyropée). Consacré à la Lune dont l’éclat rappelle celui de ce métal, son symbole deviendra tout naturellement le croissant de Lune [image 5] représenté de très nombreuses façons.
Le métal natif a longtemps été la seule source d’approvisionnement grâce aux mines d’Espagne, d’Allemagne, d’Autriche, etc., mais ce métal dont le prix était équivalent à celui de l’or (ne connaissant pas l’acide nitrique on ne séparait donc pas les deux métaux) vint, à partir de 1500, en abondance du nouveau monde. Son nom espagnol de « plata » fut rapidement associé aux noms des lieux de sa découverte.




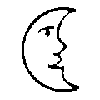
C’est vers 1663 que Glaser, en coulant le nitrate d’argent sous forme de « pierre à cautère » ou « pierre infernale », fait connaître l’existence des sels d’argent.
Après le métal natif, qui se présente souvent sous des formes compliquées (fougères, lianes), ou en petites particules mêlées à d’autres minéraux, on exploite ses sels, seuls ou combinés à d’autres métaux.
- Citons en vrac
- L’argentite Ag2 S
- la bromargyrite Ag Br
- l’argent corné (cérargurite) Ag Cl
- la dyscrasite Ag3 Sb
- la fischessérite Ag3 Au Se2
- la miargyrite Ag Sb S2
- et un très grand nombre d’autres, y compris l’électrum (alliage naturel or-argent) et l’amalgame naturel argent-mercure.
Les alchimistes rencontrent surtout l’argent dans la galène faiblement argentifère et certaines stibines. Ils peuvent le récupérer par coupellation.
Pour l’extraction industrielle à partir des minerais, on n’utilise plus directement la coupellation, mais suivant la composition de ce minerai, on pratique la cyanuration (dangereuse pour un amateur), ou bien l’amalgamation avec le mercure, puis la distillation de ce dernier, ou le grillage chlorurant (grillage en atmosphère oxydante en présence de sel de mer) qui n’est pratiquement plus utilisé.
Par contre, les procédés utilisant l’électrolyse sont très employés, surtout pour le raffinage. Une autre méthode consiste à créer un alliage Ag-Pb-Zn qui permet en fin d’opération d’arriver à une coupellation d’un alliage Pb-Ag.
L’argent provient d’un grand nombre de pays : Amérique du Sud, Amérique du Nord, Afrique du Sud, Australie, Japon, Chine, Europe, etc.
Propriétés
L’argent est le meilleur conducteur de la chaleur et de l’électricité. Il a un très grand pouvoir réflecteur et fut longtemps employé pour les miroirs de télescopes. Il faut cependant signaler qu’il est très sensible à la sulfuration qui, en l’absence de protection, produit une couche sombre en surface.
L’argent est utilisé par les alchimistes sous forme de creuset et de coupelle du fait de la très bonne tenue de ce métal vis-à-vis des bases, (fusion du KOH).
On doit à Kunkel un procédé de purification de l’argent, qui consiste à le tenir en fusion sous une couche de salpêtre, l’opération est à renouveler jusqu’à ce que le nouveau salpêtre ne soit plus coloré par les impuretés, du cuivre en particulier.
L’argent est un des constituants d’un très grand nombre d’alliages, (voir l’article « alliages divers » où quelques-uns sont cités). Quand il représente une masse de plus de 30 g, et s’il a un titre de 800 ou 925/1000, il doit porter le poinçon à la tête de Minerve [image 6].
L’oxygène se dissout dans l’argent en fusion. Lors du refroidissement rapide (au cours de la coupellation) on assiste à ce que l’on nomme « le rochage », le bouton d’argent est déformé sous la pression de l’oxygène libéré, il peut y avoir projection de métal.
Á la fin de la coupellation, l’argent métal apparaît brusquement quand le voile de litharge se déchire, on voit un court instant l’argent briller fortement, (cornutation) c’est le phénomène de l’éclair.
On purifie l’argent par fusion avec du salpêtre, on répète cette opération jusqu’à ce qu’il n’y ai plus de scories à la surface de l’argent en fusion.
Toxicologie
Les principaux risques proviennent de deux corps : Chlorure et Nitrate d’argent qui sont les plus manipulés. Il faut une bonne protection des yeux et des voies respiratoires (masque à cartouche) ainsi que le port de gants. En cas d’absorption en excès de l’argent métal, on risque l’argyrisme qui se manifeste par l’apparition d’un teint gris.
Le chlorure d’argent Ag Cl (silver chloride, en anglais) doit être stocké en emballage bien étiqueté. Il fond à 455 °C, mais à la lumière il peut émettre du chlore en se décomposant. De même, bien qu’ininflammable, s’il est pris dans un incendie.
Le chlorure peut exploser en présence d’aluminium, d’ammoniac, de potassium ou de sodium.
Le nitrate d’argent Ag NO3 (Silvère nitrate toughened, Lunar caustic, en anglais) est soluble dans l’eau 219g/100g. Il fond à 212 °C et se décompose à 444 °C en donnant de l’argent métal et des gaz (oxyde d’azote en particulier) dont il faut se protéger.
Le nitrate peut s’enflammer au contact des matières organiques, et former avec l’ammoniac un composé explosant au choc. Il est incompatible en particulier avec les agents réducteurs, les alcalis, l’ammoniac, les matières organiques, les matières oxydables ou les matières combustibles, les sels ferreux, les tartrates, les sucres, les carbonates, les iodures.
L’argent métal a une action germicide non négligeable qui l’a fait utiliser pour réaliser des gobelets et des gourdes pour conserver l’eau.
BISMUTH
Fiche technique
Formule Bi, masse molaire 208,98 g/mol, densité 9,7 à 9,83, température de fusion 271,4 °C, température d’ébullition 1420 °C. C’est un métal lamelleux, de teinte blanc grisâtre, qui cristallise facilement.
Histoire
Connu depuis 1480, mais pendant tout le Moyen-âge il est confondu avec le plomb, l’étain ou l’antimoine.
Cité au XVème siècle par Basile Valentin, il est identifié comme un métal à part, pour la première fois dans un traité d’Agricola, daté de 1520.
Suivant qu’il est redécouvert, isolé, ou obtenu en lingot, on lui a attribué des découvreurs plus récents, Hellot en 1737, Claude Geoffroy le Jeune en 1753, Marie-Adolphe Carnot vers 1870, qui découvre également un gisement en Corrèze (Meymac).
Il fut connu sous les noms de « bismutum » ou « cinererum plumbum ». Son nom de bismuth vient de l’allemand « wissmutth » et « bisemuntum ». On lui donna aussi le nom d’étain de glace.
C’est un métal peu courant, on en trouve à l’état natif sous une forme cristalline blanche, mais ses principaux minerais sont : la bismuthine, un sulfure de formule Bi 2S3 densité 6,5 masse molaire 401,34 et la bismite (bismuthocre), un oxyde de formule Bi 2O3 de masse molaire 465,96 qui fond à 825 °C.
Le bismuth provient principalement de Bolivie, Pérou, Saxe, Autriche, Oural, Australie, U.S.A., Madagascar et France.
On trouve le bismuth souvent associé, dans les mines, au cuivre, au plomb ou à l’argent. Il est de ce fait pratiquement toujours obtenu comme un sous-produit de l’exploitation des minerais de cobalt, plomb-zinc, argent-cuivre. On l’y trouve sous forme de métal (que l’on récupère par liquation comme on le fait pour séparer la stibine de sa gangue.
Propriétés
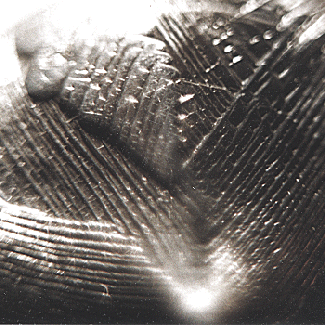
Le bismuth présente la particularité de rester en surfusion plus facilement que le plomb. Après l’avoir fondu dans une simple casserole, on le laisse refroidir jusqu’à la formation d’une pellicule en surface. On crève cette feuille figée et on verse le liquide restant. On retrouve dans la casserole des cristaux parés de belles couleurs dues à l’oxydation superficielle [images 1 & 3].
On peut également pratiquer, en ‘tirant’ le métal en cours de refroidissement à partir d’un fragment de cristal qui sert de germe.
Pour que cette opération réussisse, il faut un métal purgé de son arsenic. Pour cela, on le maintient en fusion avec une petite quantité de nitrate de potasse qui oxyde l’arsenic et le soufre..

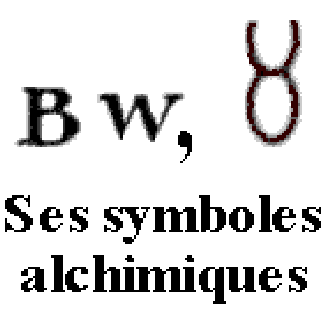

Ce métal est employé en pharmacie comme pansement gastrique (sauf en France actuellement). L’industrie l’utilise pour rendre plus durs les alliages de plomb. Sa faible température de fusion le fait utiliser comme fusible thermique pour le déclenchement des dispositifs d’arrosage automatique contre les incendies. Il forme avec le mercure des amalgames coulants et avec le plomb, le cadmium et l’étain des alliages à très bas point de fusion. Citons par exemple l’alliage Bi 50%, Cd 12,5%, Pb 25%, Sn 12,5% qui fond à 47 °C. On utilise aussi sa propriété de se dilater lors de sa solidification. Il est soluble dans l’acide nitrique concentré, mais il précipite de cette liqueur par l’addition d’eau.
Toxicologie
A part les précautions d’hygiène habituelles comme le lavage des mains, ce produit ne présente pratiquement pas de risques. Bien entendu, il ne faut pas l’ingérer et se protéger des vapeurs du métal en fusion. En cas de problème, boire de l’eau en grande quantité et pour les yeux, les laver à grande eau au moins 15 minutes.
CUIVRE
Fiche technique
Histoire
Propriétés
Toxicologie
ÉTAIN
Fiche technique
Histoire
Propriétés
Toxicologie
FER
Le fer était appelé Mars et associé au dieu [image 1] du même nom dont on fit le dieu de la guerre. Le fer est également rattaché à la planète Mars. On supposait qu’il en subissait les influences. La planète rouge renvoie aussi à la couleur de l’oxyde de fer [image 2] qui colore certaines régions terrestres dont le sol est ferrugineux.
 |
 |
|
Fiche technique :
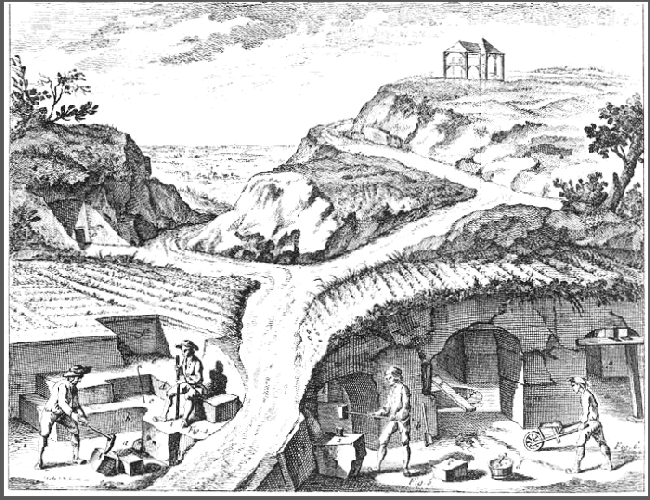
Le fer, du latin ferrum, est un métal blanc-gris, ductile, malléable, magnétique. Il a une densité de 7,88, un point de fusion de 1536 °C et une température d’ébullition de 2861 °C. De symbole Fe et de masse atomique 55,85, il est présent pour 4 à 5 grammes dans le sang d’un adulte où il joue un grand rôle dans le transport de l’oxygène. Il est très abondant dans la croûte terrestre où il est présent dans un grand nombre de minerais. Ces minerais furent exploités à l’origine dans des gisements de surface, puis par des galeries horizontales suivant le filon, ensuite par des mines peu profondes, [image 3] au pic ou avec l’aide du feu pour fragiliser le filon et l’abattre plus facilement. |
 |
|
On exploite encore de nos jours :Les acétates et des silicates.
Nous n’en citerons aucun car ils jouent un rôle négligeable. Les carbonates : Les oxydes : Les sulfures : On considère qu’un minerai de fer est pauvre, s’il contient moins de 30 % de fer, et qu’il est moyen entre 30 et 50 %, qu’il est riche à plus de 50 %. |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
|
Histoire :
Il semble évident que le premier fer travaillé par les hommes fut le fer météoritique. Il pouvait être trouvé généralement en petites masses dont la densité comparée à celle des pierres attirait automatiquement l’attention. Simplement fixé à une branche, c’était déjà une arme conférant du prestige à son possesseur. Ces petites masses, (ce sont les plus fréquentes) purent être par la suite martelées à chaud relativement facilement. Nous donnons plus loin la photo, [image 14] d’un couteau contemporain réalisé par forgeage d’une météorite. Son tranchant est parfait, comparable aux meilleurs produits de la coutellerie. Pour ce qui est du fer en provenance de minerais, l’idée est sans doute venue de l’examen de morceaux de minerai se trouvant accidentellement ‘réduits’ (privés d’oxygène) dans un feu de bois particulièrement violent (1350 °C.). On retrouve l’exploitation intentionnelle des minerais, (sans doute, au début, ramassés simplement à la surface du sol) par l’utilisation des » bas fourneaux « . Le minerai y est réduit par le charbon de bois, dans un foyer activé par le vent régnant sur des arêtes de montagnes. Plus tard, les bas fourneaux seront peu à peu construits sous forme de minitour, contenant plus de combustible et de minerai. Ils seront alimentés péniblement en air par des soufflets de peau. La technique se perfectionnant, ces simples dispositifs, (fours catalans) produisirent facilement et régulièrement des loupes de fer de plus d’un kg. On a constaté les traces, (scories) d’équipes itinérantes utilisant le minerai et le combustible présents sur place. Le bois, économiquement transportable avec les moyens de l’époque, venait rapidement à manquer du fait de la très grosse consommation. D’autres installations, fixes, utilisent ensuite des fourneaux de plus d’un mètre de haut, et quand l’environnement le permet, l’injection d’air est effectuée par des trompes à eau. L’air est entrainé par le passage de l’eau dans un tuyau, en est séparé dans une caisse à eau, puis dirigé vers la buse du bas-fourneau, (ce dernier est par ailleurs amélioré en continu). Le travail en est considérablement facilité et la taille des loupes de fer produites augmentée en proportion de la hauteur du foyer. C’est le début d’un progrès continu, conduisant aux installations modernes. En parallèle, les techniques de la forge durent obligatoirement évoluer pour traiter les loupes de fer de plus en plus lourdes, qui ne sont toujours qu’une sorte d’éponge au sortir du fourneau. On a retrouvé des traces d’utilisation ancienne de roues hydrauliques dans les forges. Les minerais de fer sont à la base de tous les ocres qui ont été utilisés depuis l’âge de pierre pour les œuvres pariétales et dans les sépultures. On les utilise toujours, naturelles ou calcinées, comme pigment dans nos peintures et tous les arts graphiques. La sanguine n’est que de l’hématite.Un ouvrage auto édité, (épuisé mais pouvant être réédité en fonction des demandes), » Mineurs et forgerons dans l’antiquité, deux faces d’une même quête « , traite largement de ce sujet pour le fer, donne des indications à propos de l’or, du plomb, du cuivre, du platine, du zinc, du mercure, ainsi qu’une approche de l’alchimie. Au besoin, nous contacter, nous sommes en liaison avec l’auteur. |
 |
|
Propriétés :
Les alchimistes, sauf de très rares exceptions, (grâce à l’acide oxalique des plantes), ne produisent pas leur fer pur, et seulement quelques personnes construisent encore des bas-fourneaux pour des démonstrations et des reconstitutions liées à des études historiques. Les alchimistes recherchent souvent du » vieux fer » dans les cercles de tonneaux plusieurs fois centenaires et autres ferronneries antiques, pour se procurer du fer supposé pur. Ce n’est qu’une illusion, car ce métal, au contraire, comporte un grand nombre d’impuretés. La seule source valable, du siècle dernier, était celle des armatures d’électro-aimants, dont le métal (fer fin de Suède) ne devait pas contenir de carbone, car ne devant pas conserver d’aimantation résiduelle. Une source, épuisée, fut constituée par les noyaux magnétiques des bras de signalisation oscillants des automobiles. Ces bras furent, après guerre, remplacés par les clignotants. Ils ont pendant un temps, encombré les casses automobiles. Il est tout de même facile, (mais coûteux) de se procurer du fer pur réduit pas l’hydrogène. Il faut cependant se poser la question de la finalité de ce choix. Consacrer du temps à se procurer un fer exempt de carbone, pour l’utiliser lors d’une séparation, conjointement avec un fondant qui en contient, est-ce bien raisonnable ? Ne voulant tout de même pas contrarier ceux qui veulent utiliser des clous à ferrer les chevaux, nous leur donnons ci-après l’adresse du site d’un fournisseur détaillant : http://www.michelvaillant.fr . Nous citerons plus loin quelques utilisations à but uniquement médical, mais les sels de fer ont eu une utilisation (et sont toujours utilisés) dans différentes voies alchimiques. Ci-dessous les principaux sels de fer : – FeO, oxyde de fer, (oxyde ferreux noir). – Fe2O3, Oxyde de fer, (oxyde ferrique rouge). C’est l’hématite pure. – Fe3O4 + Fe2O3, Oxyde noir de fer, (oxyde magnétique). Magnétite noire. – FeCl2, 4H2O, Chlorure de fer. – FeCl3, Chlorure ferrique, trichlorure de fer. – FeN3O9, 9H2O, Nitrate de fer. – FeC2O4, 2H2O, Oxalate de fer, – FeSO4, 7H2O, Fer sulfate. – FeS, Fer sulfure. – FeS2, Bisulfure de fer. – FeCO3, sidérite. – HFeO2, Oxyde d’hydroxyde de fer. Nous avons publié en 2007 un article sur le sulfate de fer, (sulfate ferreux) très employé en alchimie.Utilisation ancienne du fer en médecine empirique. Le fer a toujours été présent dans la pharmacopée des Anciens, on utilisait un très grand nombre de préparations et de variantes, propres à chaque auteur tentant d’imposer sa recette. En résumé, le but était d’obtenir un produit renfermant le fer sous la forme la moins grossière possible, ce qui était supposé faciliter son assimilation par l’organisme. O
. Il convient de signaler que le goût des remèdes à base de fer est » abominable » et que les remèdes solides dédiés aux voies internes étaient administrés sous forme de pilules, de tablettes, ou mêlés à des marmelades. Les préparations liquides étaient diluées dans des boissons sans action sur elles, (eau, vin etc.) mais non dans des décoctions d’herbes ou de racines, car elles s’y décomposaient en partie, elles prenaient alors le nom de bouillons noirs, de goût encore plus insupportable. L’eau dite » de forge « : Les Safrans (ou Saffrans). Ils sont ainsi nommés, par analogie avec l’acier rouillé qui a la même couleur, « crocus » ou « crocus martial, Crocus Martis « . Safran de Mars apéritif Safran de Mars astringent simple Safran de Mars astringent préparé par le soufre : Le soufre commencera par brûler, et immédiatement après, la matière deviendra noire. En continuant à calciner à grand feu tout en remuant, au bout d’environ deux heures la matière prendra la couleur rouge foncé, signe de la fin de l’opération. C’est un colcotar artificiel, ou » vitriol martial très calciné « . On peut l’obtenir également en calcinant pendant de longues heures de la limaille de fer au four réverbère. On lave et porphyrise plusieurs fois la limaille ainsi oxydée pour en faire une poudre impalpable. Safran de Mars antimonié Lorsque la matière sera bien en fusion, versez-la dans un cône chauffé et graissé, le régule se précipitera. Il se formera au-dessus des scories brillantes de couleur brune ; séparez ces scories, concassez-les grossièrement et exposez-les ensuite à l’ombre, dans un lieu humide, où elles tomberont bientôt d’elles-mêmes en poussière. Ethiops martial *) le procédé fut grandement accéléré par l’invention, due au Comte de La Garaye, d’une machine à triturer.
Tartre martial Prenez douze onces de limaille de fer, trente-deux onces de beau tartre blanc. Faites bouillir ce mélange dans une grande marmite, ou dans un chaudron de fer, avec douze ou quinze livres d’eau de pluie pendant une douzaine d’heures. Veillez à rajouter de l’eau pour garder le même niveau pendant l’ébullition. Laissez reposer, vous verrez au-dessus une liqueur noire qu’il faudra filtrer. Faites-la évaporer jusqu’à consistance de sirop dans une terrine de grès, au bain de sable. Vous en retirerez environ quarante-quatre onces. Cette teinture se conserve mal, c’est pourquoi on y ajoute au moins une once d’esprit de vin pour dix onces de teinture. Cette dernière, si elle est réduite à consistance de miel épais, prend le nom d’extrait de Mars. Teinture martiale alkaline (alcaline) de Stahl Fleurs martiales La boule d’acier La recette de fabrication de ces boules, d’une taille variable, proche de celle d’un œuf de pigeon, a peu évolué au fil du temps. Ensuite, les boules étaient humectées avec une préparation, (souvent alcoolique) de plantes médicinales vulnéraires. Suivant les recettes, on pouvait y trouver jusqu’à une vingtaine de plantes différentes : fenouil, calament, mélisse, sauge, thym, absinthe, romarin, benjoin, myrrhe, etc. Suivant les fabricants, la réalisation pratique de ce ferro-tartrate de potassium, et son imprégnation de médicaments, était variable et secrète. Utilisation Un produit styptique du même genre était réalisé à partir de limaille de fer et de tartre. Il était plusieurs fois humidifié de vin ou d’eau-de-vie, en alternance avec des séchages. Ce produit, sous forme de boulettes, était utilisé, comme astringent, par les chirurgiens militaires. Toxicologie À part les quelques cas cités ci-après, le fer et ses composés (si on ne les absorbe pas) ne présentent pas de risques majeurs. Le bisulfure de fer (FeS2) demande à être stocké à l’abri des acides. Le chlorure ferrique (FeCl3 anhydre) ou trichlorure de fer, point de fusion 37 °C, irrite les yeux, la peau et les voies respiratoires. Il est corrosif en cas d’ingestion. Il se décompose au-dessus de 200 °C en produisant des gaz toxiques. Il se décompose également au contact de l’eau. MAGNÉSIUMFiche technique MERCUREFiche technique ORFiche technique PLOMBFiche technique POTASSIUMFiche technique SODIUMFiche technique ZINCFiche technique Les Amis de l’Alchimie.
|


