LA LIQUEUR DES CAILLOUX
SUR NOS RAYONNAGES ON TROUVE : De la liqueur des cailloux.
|
Parmi les différents noms de cette substance, nous avons privilégié cet ancien vocable, mais on dit aussi : sirop de cailloux, verre soluble, verre liquide, ou l’on utilise sa dénomination chimique plus récente de silicate de soude.
Cette liqueur n’est composée que de deux corps : |
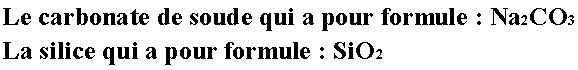 |
|
C’est donc un corps très simple à fabriquer pour un alchimiste. Le silicate de soude, de densité élevée est vendu au kg et relativement cher. Il a de nombreuses utilisations en alchimie comme dans la vie pratique.
Le rédacteur s’en servait dans sa jeunesse, à l’époque des postes à lampes, pour immobiliser les ampoules radio qui s’étaient désolidarisées de leur culot. Il mangeait des œufs qui avaient été conservés (sans frigo) par immersion dans une solution diluée de ce silicate et destinée à isoler la coquille de l’air . Le silicate est utilisé dans l’industrie pour faire des colles, des peintures pétrifiantes, des lessives. Il a longtemps été utilisé comme colle pour la fabrication du contreplaqué. Si la teneur en silice est de 3,9 pour 1 de soude, on obtient la formation d’un gel aussi élastique que du caoutchouc. Si, dans une solution de silicate de soude à 26%, on ajoute de l’acide sulfurique dilué, l’acide forme, avec la soude, du sulfate de soude qui reste en solution. La silice libérée se prend rapidement en une masse cristalline spongieuse qu’il faut triturer, (dans le liquide) pour la réduire en petites portions (vous pouvez la forcer à passer au travers des trous d’une écumoire). Il faut ensuite laver abondamment ces grains à l’eau non calcaire jusqu’à obtenir un pH neutre, ensuite on la sèche lentement au four, vers 50 °C. Si on le désire, on remouille quelques cristaux avec une faible solution colorante de protochlorure de cobalt et on sèche à nouveau. Nous nous trouvons alors en possession de « gel de silice » composé de silice pure et inerte chimiquement. Ces grains présentent une surface développée considérable du fait de leur mode d’obtention et sont avides d’humidité. Vous êtes en possession de dessicateur dont les grains indicateurs bleus vireront à la teinte lilas, puis rose en se chargeant d’humidité. En les passant à l’étuve, les grains reprendront leur teinte bleue pour un nouvel usage. Le silicate de soude permet d’imprégner de nombreux corps : pierre, brique réfractaire, plâtre, pour les durcir et leur donner une tenue au feu. C’est un protecteur hydrofuge et ignifuge (tenue, environ 1100°), Il est injecté avec des bétons pour stabiliser des sols. C’est un fondant abaissant le point de fusion des argiles. Nous ne pouvons pas passer sous silence la thèse du professeur J. Davidovits sur la composition des pierres des pyramides, il y voit un ciment produit à partir de natron de chaux et d’argile. Nous utilisons le silicate surtout pour imprégner légèrement la fibre de silice ordinaire, pour en faire un substitut de la fibre humide. Cette dernière vendue très cher, (quand on en trouve) est de conservation très limitée et vendue avec un minimum de commande. Cet état de fait nous pose problème, la date de livraison étant inconnue ne permet pas d’organiser un stage pour l’utiliser de façon judicieuse. Les composants : |
 |
|
Dans un passé récent, le carbonate était tiré par lessivage des cendres d’algues (varech ou goémon) en Bretagne ou d’une plante, (la salicorne) en Méditerranée. C’est l’homologue du carbonate de potasse que vous tirez de vos cendres de chêne (pourri ?).
La silice, c’est un des composants les plus répandus dans la nature. C’est un dioxyde de silicium, le plus connu est le quartz. Quand ce quartz est translucide on parle de cristal de roche. Rassurez-vous, votre collection de minéraux ne craint rien. Du sable blanc de silice ou du silex feront l’affaire, il faut simplement les réduire en poudre. Pour faciliter le broyage, il convient de porter au rouge le minéral choisi et de le précipiter dans l’eau. On répète l’opération pour obtenir la quantité désirée de sable et on ignore les morceaux récalcitrants. On trouve aussi de la silice broyée chez les fournisseurs de produits pour céramique, (voir ADRESSES) et si sa teinte vous donne du verre liquide coloré, c’est sans importance. La fabrication : |
|
Paul Melleret
|
