L E S U L F A T E D E C U I V R E (Thème de stage).
Le cuivre est un métal connu depuis la plus haute antiquité, (au début cependant seul le cuivre natif était utilisé). Il est donc évident que les écoulements suintants des gisements ou des mines ont été remarqués rapidement, surtout par la formation de cristallisations caractéristiques.
Il semble qu’il faille attendre, en Occident, la période d’Albert le Grand pour que les alchimistes en parlent sous les noms de couperose, vitriol bleu.
Ce produit naturel s’échappant jadis des mines, les chimistes le nomment Sulfate de Cuivre.
On retrouve encore dans la littérature de toutes les époques les dénominations suivantes : vitriol bleu (à cause de sa couleur), couperose bleue, sulfate de cuivre, sulfate cuivrique, sulfate cuivrique penta hydraté.
C’est ce dernier, de formule Cu SO4 + 5H2O qui fera l’objet de cet article.
Sa masse molaire est de 269,68 g/mol. Sa densité est de 2,29 g/cc.
Sa solubilité dans l’eau à 20° C est de 370 g/litre (elle triple à 80° C)
Il est soluble également dans la glycérine et le méthanol.
Il est insoluble dans l’éthanol et les autres alcools.
Le pH d’une solution de 50 g/litre dans l’eau à 20° C est compris entre 3,5 et 4,5.
En le chauffant, le sulfate perd son eau de cristallisation et devient blanc. (il reprend sa teinte bleue en se réhydratant).
Il se décompose vers 560° C.
Nota : Une variété géologique de cristaux, la Bonattite n’a que 3 molécules d’eau.
OBTENTION :
Les Anciens obtenaient ce sulfate par récupération des eaux d’écoulement des mines et évaporation naturelle, ou par chauffage. Par la suite, ils grillèrent en tas des mélanges de combustible et de minerais contenant des sulfures de cuivre, exemple la Chalcosine (ou chalcosite) de formule Cu2S ou des pyrites cuivreuses, exemple la Chalcopyrite de formule Cu2S, Fe2S3.
Nous pouvons griller, pour les oxyder, des chutes de cuivre, puis traiter cet oxyde à l’acide sulfurique. Cependant, il nous a semblé plus simple de partir de chutes de cuivre laminées très mince, ou à défaut de fils de cuivre très fins que l’on peut se procurer facilement chez les ferrailleurs. Nous disons « très fins », car du fil de 0,05 mm de diamètre présente une surface d’attaque à l’acide 20 fois plus importante, à poids égal, que du fil de 1 mm de diamètre.
L’attaque des morceaux de fil se fait à chaud par de l’acide sulfurique concentré (l’esprit de Vitriol Romain d’Albert le Grand). Vous pouvez concentrer préalablement l’acide vendu en grande surface (il est parfaitement inutile d’utiliser une qualité Prolabo) ou admettre que dans un premier temps, il y aura à l’ébullition, évaporation de l’eau excédentaire avant que l’attaque ne se manifeste.
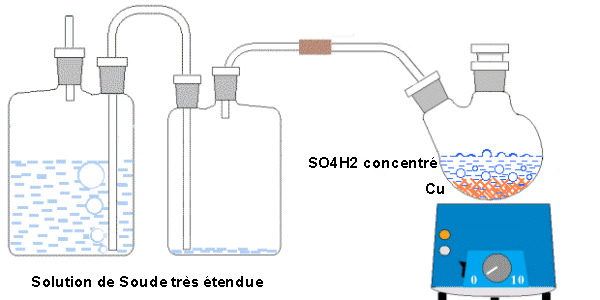
Ci-dessous, le montage théorique proposé. Les barboteurs sont garnis d’eau rendue basique par 10 % de lessive de soude (vendue en grandes surfaces) de façon à éviter que l’hydrogène généré par l’opération ne ressorte du montage accompagné de traces d’acide.
Il est suivi de deux exemples de montages pratiques.
|
 |
 |
 |
 |
Nota : Les niveaux des barboteurs sont à régler de façon que :
Premièrement : il ne puisse pas y avoir d’aspiration et retour de la solution basique dans le récipient contenant l’acide et le cuivre, en cas de refroidissement accidentel de ce récipient.
Deuxièmement : il n’y ait pas de sortie de liquide basique par débordement du deuxième barboteur.
Si l’acide est étendu d’eau, la vapeur de cette dernière se condensera dans les barboteurs, dont il y aura lieu de surveiller et corriger au besoin les niveaux.
On se contentera, (pour éviter des calculs incertains) de faire en sorte d’avoir toujours un excès de cuivre en fin d’opération. On récupérera le liquide par filtration, non pas sur de l’amiante, mais sur du coton de verre (Prolabo) ou de la fibre de silice, (fibre en vrac de chez Céradel par exemple). Ce liquide sera refroidi préalablement un peu au-dessous de l’ambiance pour éviter sa cristallisation dans le filtre.
Ensuite, viendront les purifications par cristallisations successives. Si l’on dispose d’un emplacement dans un frigo, on peut faire un cycle par 24 heures.
On récupère les cristaux déposés, on les rince à l’alcool à 90° C et on les met de côté.
On réduit par la chaleur le volume du liquide de 1/3, on remet à cristalliser et ainsi de suite. Quand il ne reste plus beaucoup de liquide, on n’insiste pas. C’est dans ce reliquat que se sont concentrées les impuretés, on le dilue très fortement avant de le jeter à l’évier. Dans cet état, sa toxicité est devenue négligeable (ne pas oublier qu’on l’utilise massivement pour traiter les vignes et qu’il est utilisé pour colorer les haricots verts de conserve).
Bien que présent dans le corps humain, le cuivre dont la carence est à compenser par la prise de cuivre sous forme d’oligo-éléments, il ne faut pas négliger le port de gants. Si vous lisez qu’il ne s’agit que de travail de femmes et d’enfants, rappelez-vous que la loi interdit la vente de sulfate de cuivre (et de fer) sous la forme de cristaux, justement parce que les enfants peuvent être tentés de les porter à la bouche.
On reprend les cristaux réservés précédemment, on les dilue dans de l’eau distillée ou de pluie bien filtrée (jamais de l’eau calcaire ou celle du robinet). On fait cristalliser la solution cette fois très lentement, et on reproduit ce cycle plusieurs fois. Au fur et à mesure de ces cristallisations, le dépôt se composera de cristaux bien formés et de plus en plus gros et on peut même dire de plus en plus beaux. Voir les images du début à la fin des opérations.
|
 |
 |
 |
 |
En l’absence de germe, (souvent une simple poussière) il est possible que la solution reste en sursaturation, puis cristallise d’un seul coup à la suite d’une vibration. Pour éviter cela, il suffit de déposer ou bien de suspendre à un fil, dans le récipient d’évaporation, un des petits cristaux récupérés précédemment qui deviendra le germe de la nouvelle cristallisation.
Les alchimistes ont, de tous temps, cultivé l’art de ces cristallisations très lentes dans leurs recherches pour l’obtention de pierres précieuses.
|








