|
Pour mon article sur le Mercure vierge, je pensais avoir respecté les conditions : tout décrire dans le détail, pour ne rien cacher à des débutants.
Eh bien, rapidement le courrier m’a donné tort. Je n’avais pas expliqué comment on contrôle la concentration du minerai. Je vais donc satisfaire au moins deux lecteurs, je vais même aller plus loin, et élargir le sujet. J’ai pour cela refait l’expérience sur mon cinabre, (ne m’en veuillez pas si j’ai triché de quelques % pour retomber sur les 138 g. de l’article en question, car l’échantillon que j’ai utilisé pour le présent article, n’est pas du même lot qu’il y a 15 ans). Pour commencer, j’ai utilisé le mot roches pour parler de façon générale, le pétrole est une roche qui bien évidement est exclu de cet article. Les minerais (ce qui nous importe) sont des roches, mais toutes les roches ne sont pas des minerais. Je parlerai ici de mesures effectuées sur des minerais solides accompagnés d’une gangue. Les mesures passent par celle du poids spécifique, (masse mesurée d’un volume donné de matière) par exemple le poids spécifique de soufre est de 2064 Kg par mètre cube. Et par celle de la densité qui est le rapport du poids d’un volume donné à celui du même volume d’eau, la densité du mercure est de 13,6 (nombre sans unité). Bien entendu, ceci dans les conditions de pression et de température habituelles (par exemple, le mercure congelé, à l’opposé de la glace, se contracte et sa densité passe à 14,6). Le poids spécifique théorique, prévu par la formule chimique est inutilisable car différent de celui trouvé pour le minerai sans gangue. En effet, l’arrangement des molécules composant le minerai peut conduire à une contraction du volume, (par analogie : 1000 Kg de gravier + 1000 Kg de sable font toujours 2000 Kg si on les mélange, mais 1 mètre cube de gravier mélangé à 1 mètre cube de sable font beaucoup moins de 2 mètres cube). A l’opposé, par exemple, le volume de la poudre de salpêtre est très inférieur au volume de ce même salpêtre cristallisé. A signaler : un corps cristallisé contient en outre, de l’eau de cristallisation et de l’eau d’interposition dans les conditions normales. Formule cinabre : HgS
1 mole de Hg fait 200,59 g. donc en divisant par le poids spécifique 13,6 g./cc. = 14,749 cc. 1 mole de S fait 32 g., qui divisés par 2,064 g./cc. représentent un volume de 15,504 cc. soit un total de 232, 59 g. pour un volume de 30,253 centimètres cube. La densité théorique du cinabre est donc de : 232,59 / 30,253 = 7,688 J’utiliserai la densité pratique constatée par les minéralogistes : 8,175
Pour mesurer la densité d’une roche, (non poreuse) on utilise, depuis un certain Archimède, la même technique qui consiste à dire : tout corps plongé dans un liquide exerce sur ce dernier une poussée dirigée de haut en bas et égale au poids du liquide déplacé.
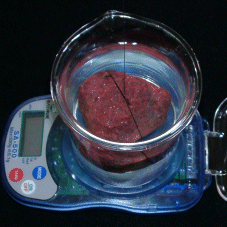
Donc, on pèse en premier un échantillon sec de la roche en question. On le munit d’un fil de suspension. Vous ne chicanerez pas sur le volume ou le poids de ce bout de fil ! On pose, sur une balance, un récipient contenant suffisamment d’eau pour pouvoir y immerger totalement l’échantillon, (retenu par le fil de façon à ne toucher, ni le fond, ni les parois) mais en veillant à faire disparaître les petites bulles d’air qui restent collées à l’échantillon. Si vous avez fait la tare de la balance avec le récipient d’eau, le nombre que vous lisez (en grammes) est celui du volume en centimètre cube de l’échantillon. La seule difficulté est de choisir un récipient qui utilise au mieux la sensibilité de la balance, et qu’avec l’échantillon plongé dans l’eau, la portée maximum de la balance ne soit pas dépassée. |
 |
 |
|
La masse de mon échantillon a été trouvée de 167,4 g. Et son volume de 43,3 cc.
Sa densité est donc de 167,4 / 43,3 = 3,866 très inférieure à celle du minerai pur. La même opération faite avec un morceau de gangue séparée m’a donné une densité de 2,8.Si mon échantillon avait été du pur cinabre, il aurait pesé 43,3 x 8,175 = 353,98 g. Soit 353,98 – 167,4 = 186,58 g. de plus. Chaque fois qu’un centimètre cube de cinabre est remplacé dans l’échantillon par de la gangue, la masse de l’échantillon est plus faible de 8,175 – 2,8 = 5,375 g. Il en résulte que mon échantillon contient : 186,58 / 5,375 soit 34,71 centimètres cube de gangue. Et donc 43,3 – 34,71 = 8,59 centimètres cube de cinabre. Ce qui représente en poids seulement 42 % de cinabre, contre 58 % de gangue. Dans l’article sur le mercure vierge, j’avais pris 1/4 de mole de cinabre pour environ 58 g. ; il faut prendre, avec mon cinabre : 58 / 42% soit 138 g. J’espère, cette fois, avoir été complète et ne pas avoir déclenché une polémique genre serpent de mer.
|
|
Aude Haizange
|
